【同位体】って何?
この記事では科学的な知識なくても理解できるよう専門用語の説明や、イラストを使ってわかりやすく解説していきます。
一般的に同位体とは
と説明されますが、この一文で同位体の意味を理解できるのは、科学 (化学) 的な知識を持つ一部の人に限られます。
だって、短い文章に専門用語がぎっしりですからね。
でも、安心してください。この記事を読めば、5分で同位体の概念を理解できます。
同位体は原子に関係する話 では、そもそも原子ってなに?
同位体とは何かを理解するためには、まず原子の構造を理解する必要があります。
とは言っても難しく考えないでください。
ここでは簡単のため、原子とは空気や水などの物質を構成する非常に小さい粒であるとイメージしてください。
例えば、酸素:O2 は酸素原子 (O) が、水:H2O は水素原子 (H) と酸素原子 (O) で構成されています。
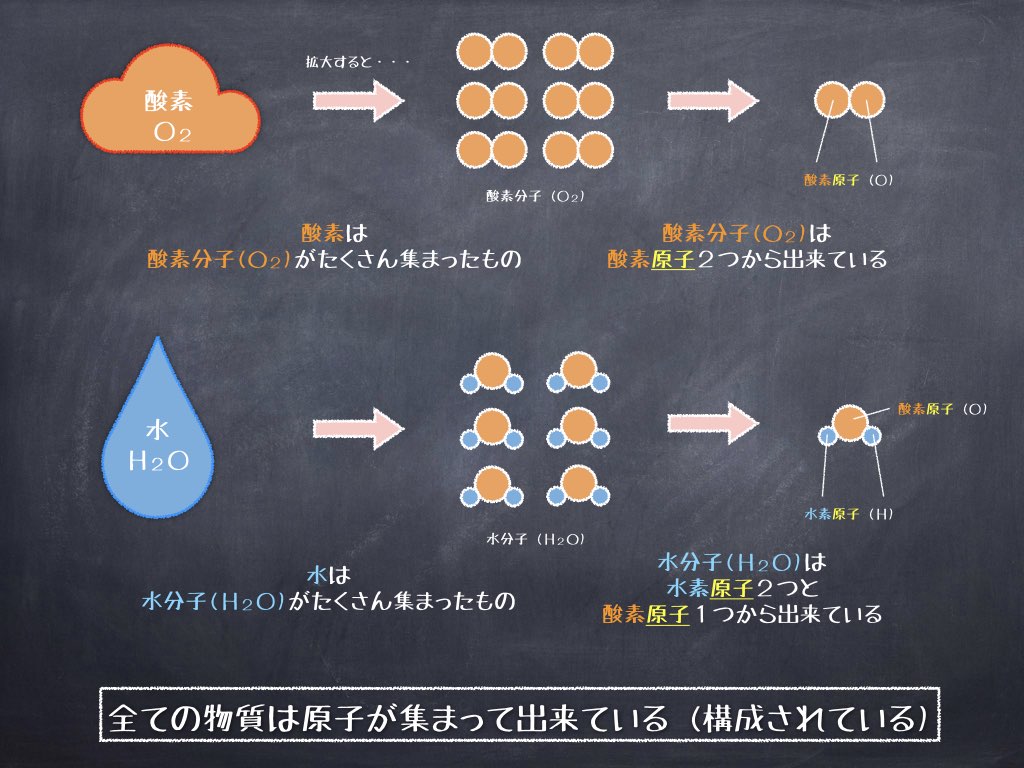
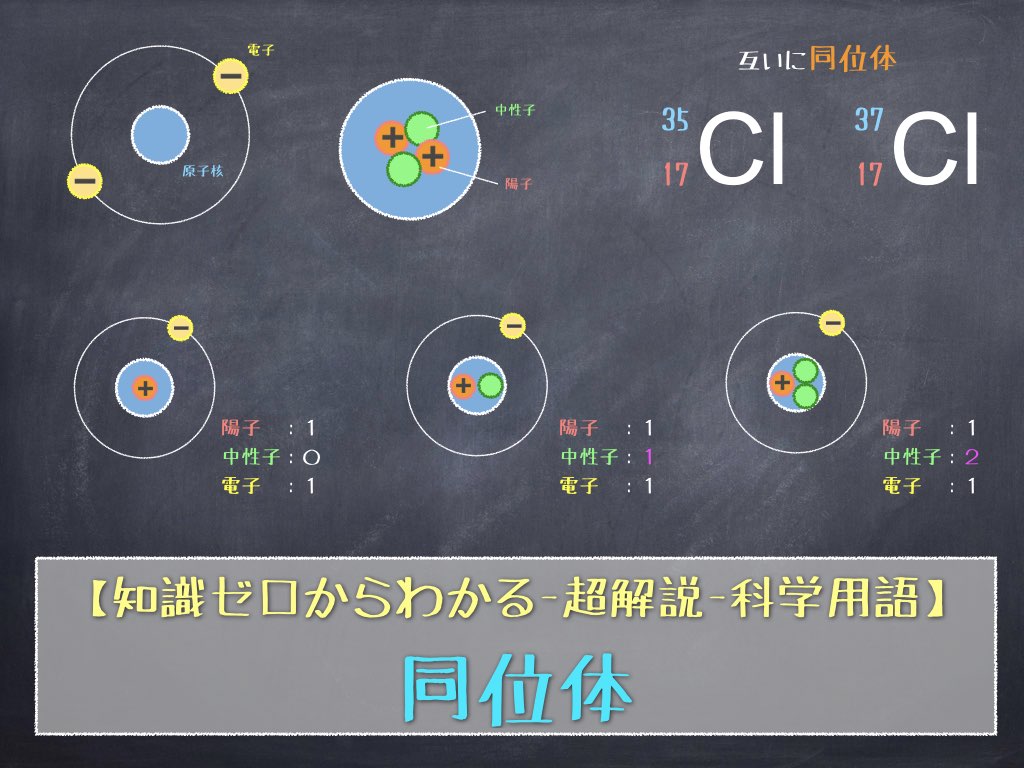
それぞれの原子をさらに細かく見ていくと、原子は原子核とその周りを取り巻く電子で出来ており、原子の中心にある原子核は、陽子と中性子から構成されています。
ここでいくつか出てきた単語を整理しておきましょう。
- 電子はー (マイナス) の電気量を持った粒子 :電子はマイナスの電荷を持つ
- 陽子は+ (プラス) の電気量を持った粒子 :陽子はプラスの電荷を持つ
また、電子 (−)1つ と陽子(+) 1つ では合計での電気量はゼロ (中性) となります。つまり、電子と陽子の持つ電気量は等しいわけです。
一方、原子核の中に含まれる中性子は電荷を持たない粒子 (プラスでもマイナスでもない) で、いくつあっても原子の電気的な性質に影響を与えない粒子です。

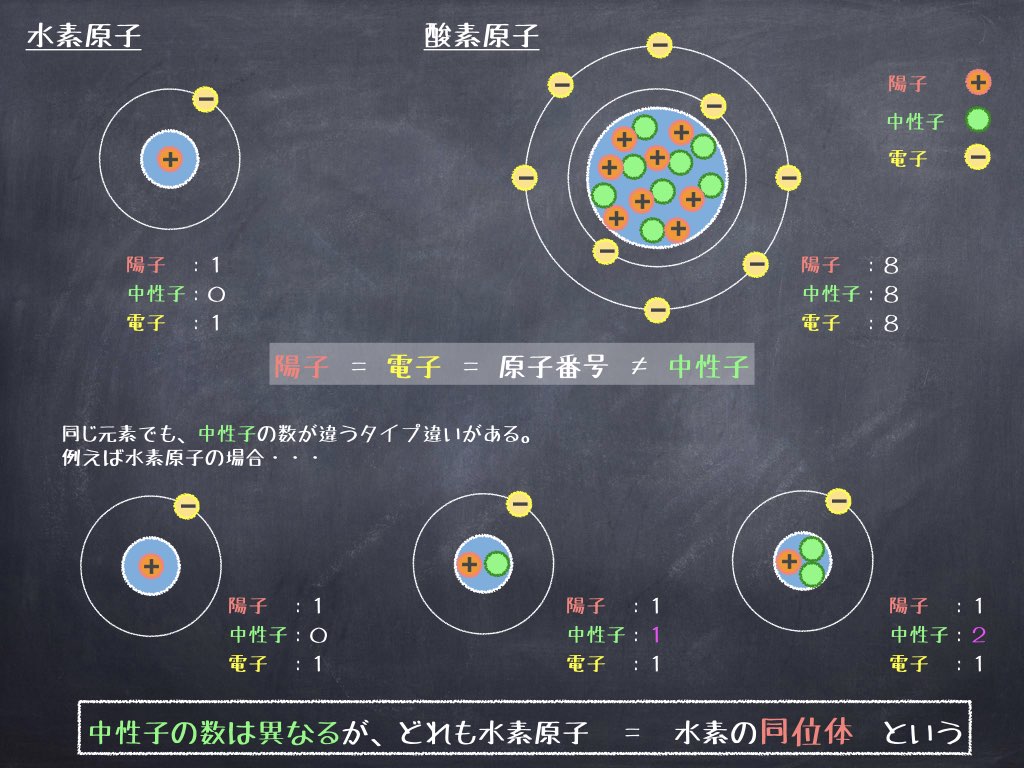
原子核に含まれる陽子の数は、それぞれの元素によって異なっており、元素の性質を特徴付ける”もと”になっています。
例えば水素原子 (H) は1つ、ヘリウム原子 (He) 2つ、酸素原子 (O) 8つ の陽子を持っており、この数は原子番号に対応しています。
原子番号:H=1、He=2、O=8
また、原子核の周りを取り巻く電子の数は陽子の数に等しく、水素原子の場合は1つ、酸素原子の場合は8つ と原子番号と同じだけの電子が原子核の周りを取り巻いています。
同位体とは
では、中性子の数はどうでしょうか?
例えば多くの場合、陽子、電子、中性子の数は以下のようになっています。
- 水素原子: 陽子:1、 電子:1、 中性子:0
- 酸素原子: 陽子:8、 電子:8、 中性子:8
ただし、これらは多くの場合と注記したように、例外も存在しています。
前の説明のように、元素ごとに持っている 陽子と電子の数は原子番号と等しい固有の数なのですが、中性子は必ずしも原子番号と同じ数とは限らないのです。
各元素の名前 (水素、酸素など) は陽子の数によって決まりますが、同じ陽子の数 (元素) であっても、中には中性子の数が異なる原子も存在します。これを “同位体” と呼び「同一元素の原子で中性子の数が異なる原子同士のこと」を指します。
重要ワード:質量数とは
同位体とはどういったものなのか、何となくイメージはつかめたでしょうか?
最後にもう1つ単語の整理をしておきましょう。
冒頭の同位体の一般的な説明で出てきた「質量数」についてです。ここまで読んでいたいただいた”あなた”にとっては、何も難しくはありません。
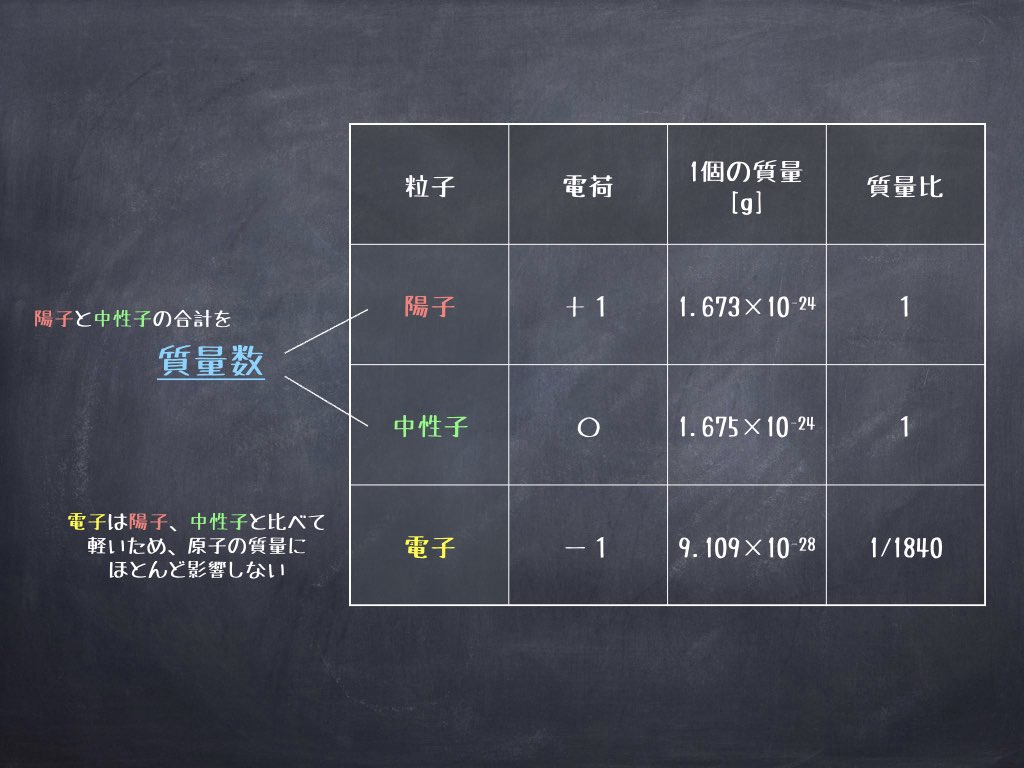
質量数とは、陽子と中性子の数を合計した数値を意味します。
つまり、陽子:1、中性子:0 の水素原子の質量数は1+0=1
陽子:8、中性子:8 の酸素原子の質量数は8+8=16 となります。
「質量数に電子の数は含めいないの?」 と質問が飛んできそうですが、「含めません」 なぜなら、原子の質量はほとんど陽子と中性子で決定されるためです。
簡単に言うと、電子はものすごく軽いため原子の質量にほとんど影響しないというわけです。
※電子の質量は陽子、中性子と比べて1/1840しかなく原子の質量を考える上では、電子の質量はほとんど無視して良いことなります。
同位体と原子量の関係
同位体を持つ元素としては、水素、炭素、窒素 (N)、酸素 (O)、塩素 (Cl)・・・と様々元素が挙げられますが、同位体どうしの化学的性質は非常に似ており、地球上の元素はこれらの同位体が一定の割合で混ざった状態で存在しています。
例えば、塩素は質量数 35、37の同位体がそれぞれ 約75.8%、24.2%の割合で存在しています。
周期表をみると、塩素の原子量は 35.45と表記されていますが、この数値は塩素の同位体比率が考慮されています。
試しに計算してみましょう。だいたい35.45くらい数値になるはずです。
※厳密には質量数が35、37ぴったりではないため、上の数値で計算するとズレが生じる。(詳しくは補足で)
同位体の表記方法
通常、特定の元素を表す際には、H や Cl などの元素記号で表し、この場合同位体としての区別は特にさられておらず、それぞれの同位体が一定の存在比で混ざり合ったものとして取り扱われます。(塩素の例では、質量数 35と37の塩素が混ざり合った状態)
ただし、明確に同位体を区別したい場合には、元素記号の左上、左下に数字を書き加える以下のような表記ルールを用います。
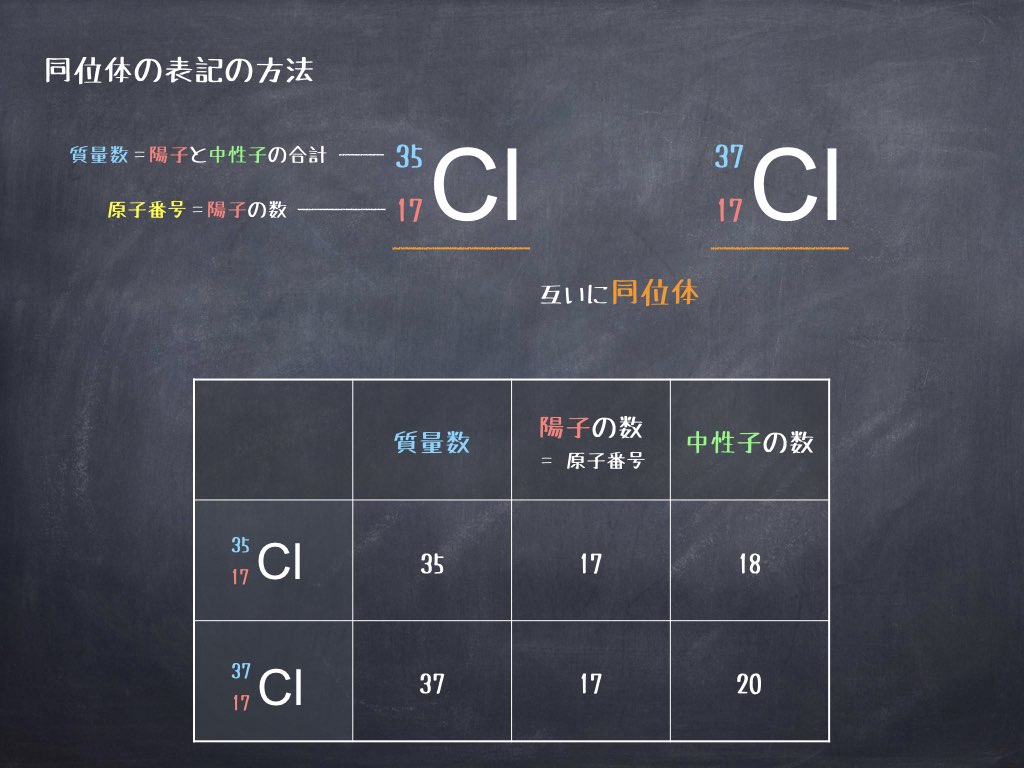
元素記号の左上の数字は質量数、左下の数字は原子番号 を意味します。
元素記号と原子番号は元素によって決まっていているため、同じ元素 (例えば水素 H、塩素 Cl) であれば、この部分は変化しません。変わるのは左上の質量数だけです。そんなに難しくないですよね。
おわりに
最後にもう一度だけ、最初の “一般的な同位体” の説明に戻ってみましょう。
この記事を読む前までは、専門用語満載で意味不明だった説明文が簡単に理解できるはずですよ。
順を追って見てみると、難しそうな科学用語もすんなり理解できるようになりますね。
補足
塩素の原子量の計算 (厳密バージョン)
36.968 ✖️0.7576 ➕ 36.966 ✖️0.2424 = 35.45
陽子や電子の持つ電気量
陽子はプラス、電子はマイナスの電気量としてそれぞれ約1.60×10−19 [C] の電気量を持っている。(単位:クーロン)


コメント